Computer System Validierung (CSV)
Pharma- und Medical-Device-Unternehmen unterliegen strengen nationalen und inter-
nationalen Richtlinien. Ebenso müssen Lieferanten, Hersteller von Wirkstoffen sowie die
Verpackungsindustrie die Richtlinien und Gesetze der FDA, ISO-Normen, EUGMP und
weitere erfüllen.
Deshalb ist die Validierung von Computersystemen in der Pharma- und Medizin-
produktindustrie unerlässlich. Die FDA definiert Prozessvalidierung als die Erstellung
von dokumentierten Nachweisen, die ein hohes Maß an Sicherheit bietet und ein
bestimmter Prozess, der ein Produkt produziert, seinen vorgegebenen Spezifikationen und
Qualitätsmerkmalen entspricht. Die Validierung liefert den Nachweis, dass ein Prozess
klar und wiederholbar ist und den Audits standhält. CSV erbringt dokumentierte Nachweise,
dass jedes am Herstellungsprozess beteiligte Objekt jederzeit nach Spezifikation arbeitet.
Meine Erfahrung für Ihre Herausforderung
Unabhängig davon, in welcher Projektphase Sie sich befinden: Ich stehe Ihnen mit
umfassendem Know-how zur Seite und unterstütze Sie durch hohe Kommunikations-
und Methodenkompetenz.
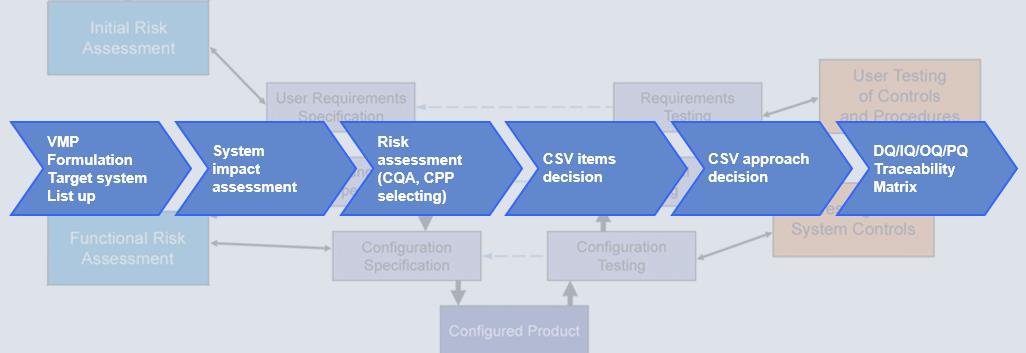
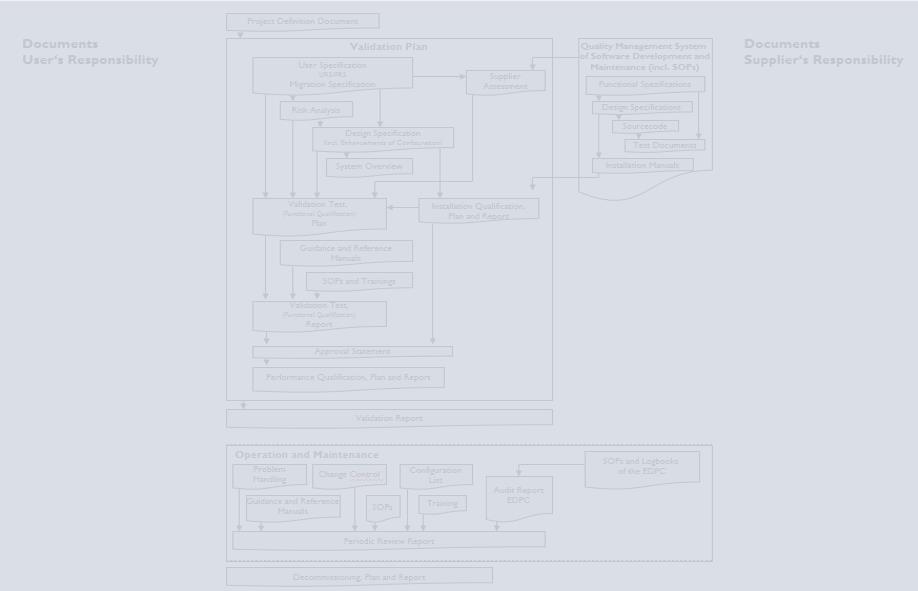
Schlüsselkomponenten eines Validierungsplans
- Eine Risikobewertung
- Ein vollständiger, systematischer Plan, der das Projekt detailliert beschreibt und zeigt,
wer und was erforderlich ist, um es abzuschließen.
- Detaillierte Schritte, die zu unternehmen sind, um die notwendigen Nachweise für die
Validierung des Systems zu erbringen.
- Ein Plan für die Prüfung der einzelnen Abschnitte des Projekts
- Testfälle zur Ermittlung der Testergebnisse
- Eine Zusammenfassung des Validierungsplans
- Eine Roadmap für Verfahren nach Abschluss der Validierung
Wenn Sie Fragen haben – ich berate Sie gerne.
Dr. Ulrich Gräff
Principal Consultant - Risk & Compliance GxP
Buchbornstraße 10
60488 Frankfurt am Main
Telefon: +49 (0) 69 - 97 52 86 57
mail@ulrich-graeff.de
USt-ID: DE313231746